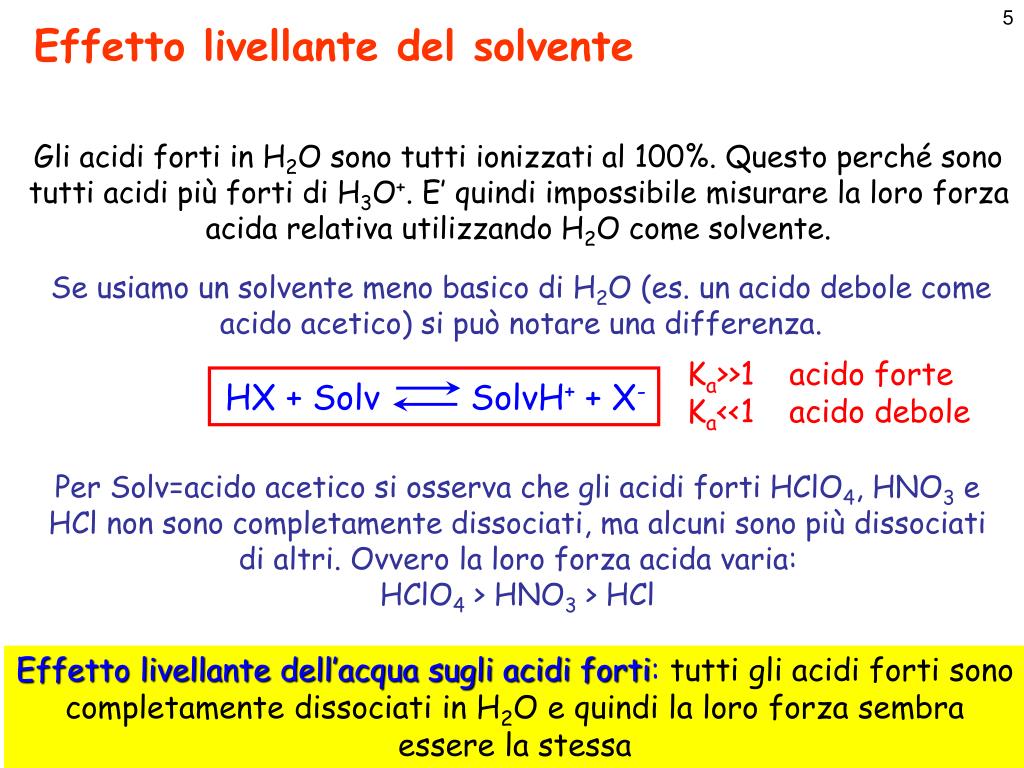
Le soluzioni tampone sono soluzioni contenenti miscele di soluti che impediscono significative variazioni di pH per aggiunta di moderate quantità di acidi e di basi forti.. Esse possono contenere contemporaneamente, in concentrazioni all'incirca uguali: un acido debole e la sua base coniugata. esempio CH 3 COOH / CH 3 COONa. oppure . una base debole e il suo acido coniugato. Acidi e basi: forti e deboli Sappiamo che gli acidi hanno una caratteristica che li accomuna (in soluzione acquosa forniscono ioni H+), ma hanno anche una proprietà che li differenzia, cioè la «forza». Essa misura la capacità della molecola dell'acido di liberare più o

"Esercizio Reazione tra Acido forte e Base debole Avanza acido" ManueleAtzeni ISCRIVITI

Titolazione Acido Debole Base Forte Punto Equivalente marjetti
Hno3 Acido Forte O Debole thaqabia

Curva Titolazione Acido Forte Base Forte erasquyes

Hcl Acido Forte O Debole princeselsa
Quando un elettrolita si dice forte? Qual è lo

Titolazioni acido debole base forte. Esercizi svolti Chimicamo

Nh3 Base Forte O Debole kasrusso

Come si fa a capire se un acido e debole o forte? (2023)

Neutralizzazione di un acido debole con una base forte YouTube

Ph Acido Debole Base Forte sulikrah

Hcl Acido Forte O Debole princeselsa

Liste des acides forts et faibles courants Carlos Ramirez

ACIDI E BASI DEBOLI completo YouTube

Diluendo soluzioni di un acido forte o debole
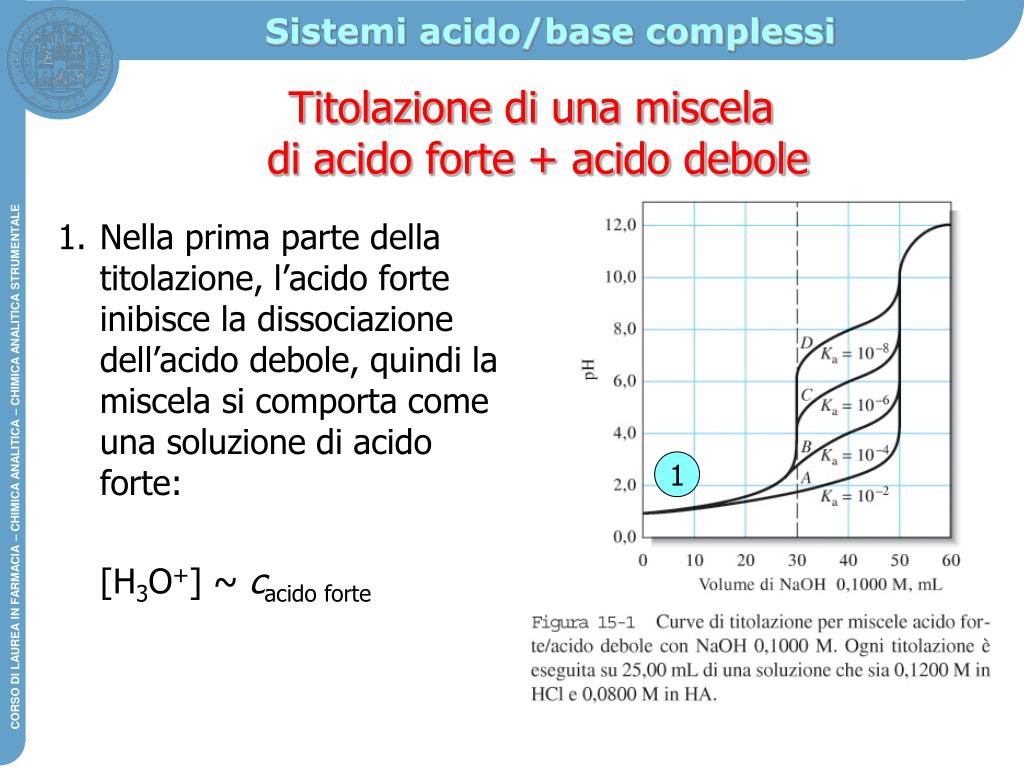
Grafico Titolazione Acido Debole Base Forte oqudina

LA COSTANTE DI DISSOCIAZIONE DI ACIDI E BASI DEBOLI YouTube

Diluendo soluzioni di un acido forte o debole
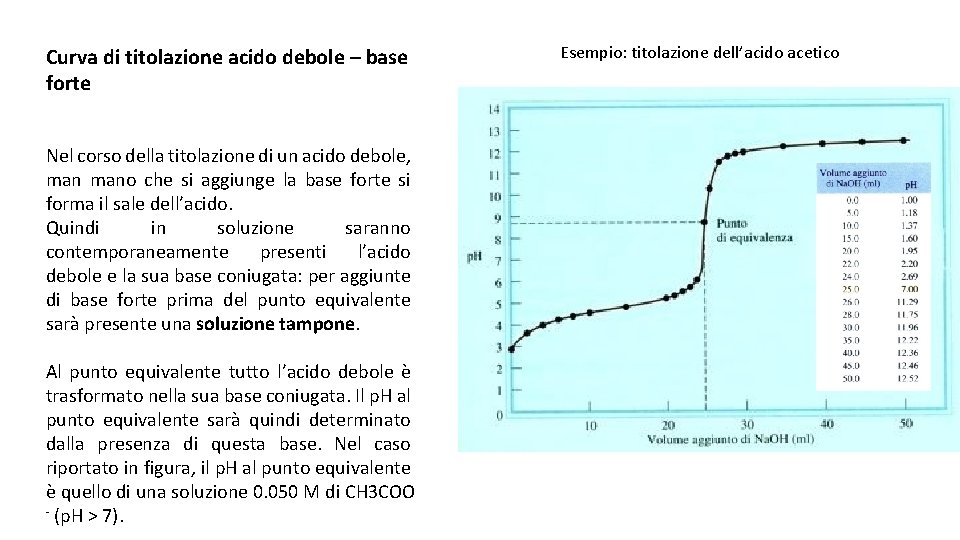
Curva di titolazione acido debole base forte Nel
Ph Acido Debole Base Forte sulikrah
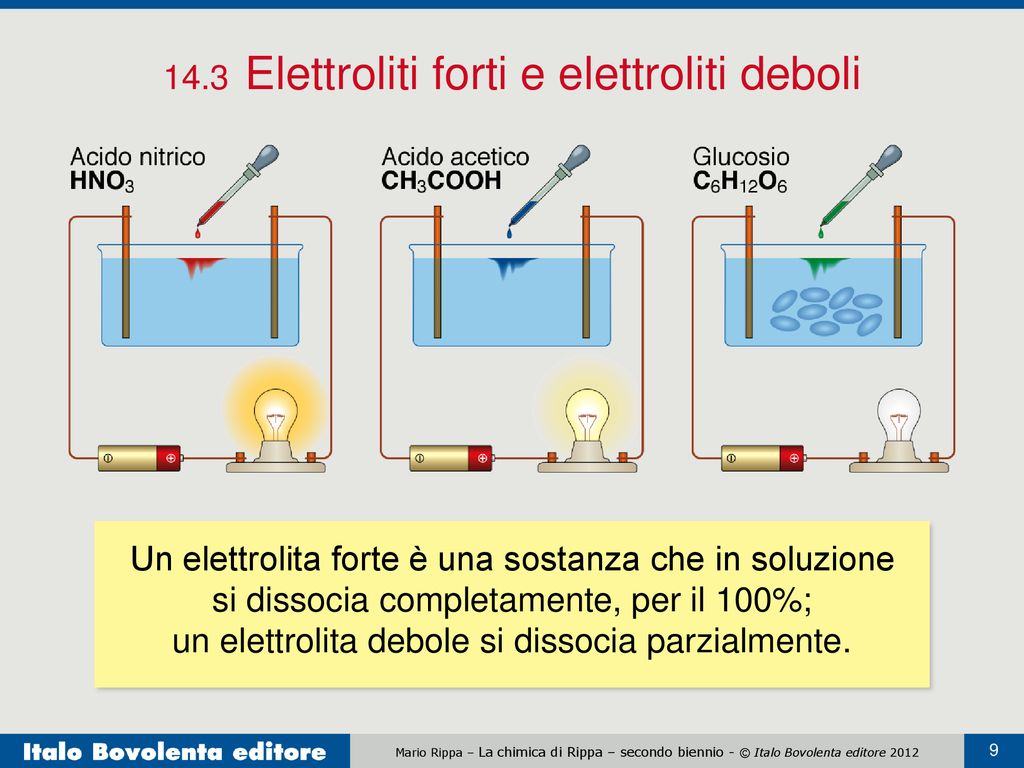
L'acido solfidrico (o idrogeno solforato, nome IUPAC solfuro di diidrogeno) è un idracido debole, diprotico, gas incolore a temperatura ambiente, contraddistinto dal caratteristico odore di uova marce; la sua formula chimica è H 2 S.Il suo nome sistematico, sebbene sia usato solo in qualche suo derivato, è solfano, analogo a fosfano per PH 3 (), ed è anche il più semplice idruro di zolfo.. Per determinare se un acido è forte o debole, è possibile considerare diversi fattori: 1. Dissociazione ionica. Un acido forte si dissocia completamente in soluzione acquosa, producendo un elevato numero di ioni H+. Un acido debole, invece, si dissocia solo parzialmente, generando un numero limitato di ioni H+. 2.